
當前位置:首頁 > 技術支持 > 食用、食品類 > GB 1892-2007中測定CaSO4有效含量誤差分析
在最新的國標GB 1892-2007《食品添加劑 硫酸鈣》中對CaSO4有效含量的規定由原來的不小于95%提高到不小于98%,這就對檢驗操作的過程要求更加嚴格。但是在整個檢驗滴定的過程中,檢驗員對反應程度和滴定液顏色的判斷會對最終的檢驗結果產生直接的影響,所以在某些方面會因為判斷的不準確性從而產生一定的檢驗誤差,對最終檢驗結果的判定造成影響。分析產生誤差的原因,主要體現在以下幾個方面:
一、加入KOH溶液的體積對檢驗結果的影響
在GB1892-2007中的第6.4.3分析步驟中“加入1滴甲基紅指示液,滴加氫氧化鉀溶液至溶液顯橙紅色”這一過程可是認為是整個測定過程的關鍵性步驟之一,加入的氫氧化鉀溶液體積的多少對測定結果會產生直接的影響,加入的KOH溶液過量則無法出現滴定的終點,加入量的太少則無法測定。
主要的原因是由于用EDTA測定Ca2+的濃度時,是以鈣試劑做為指示劑屬于偶氮染料,它是四元弱酸,其離解方程式如下:
H2In- pKa2=7.4 HIn2- pKa3=13.5 In3-
酒紅色 ———— 藍色 —————— 酒紅色
其分子結構式:
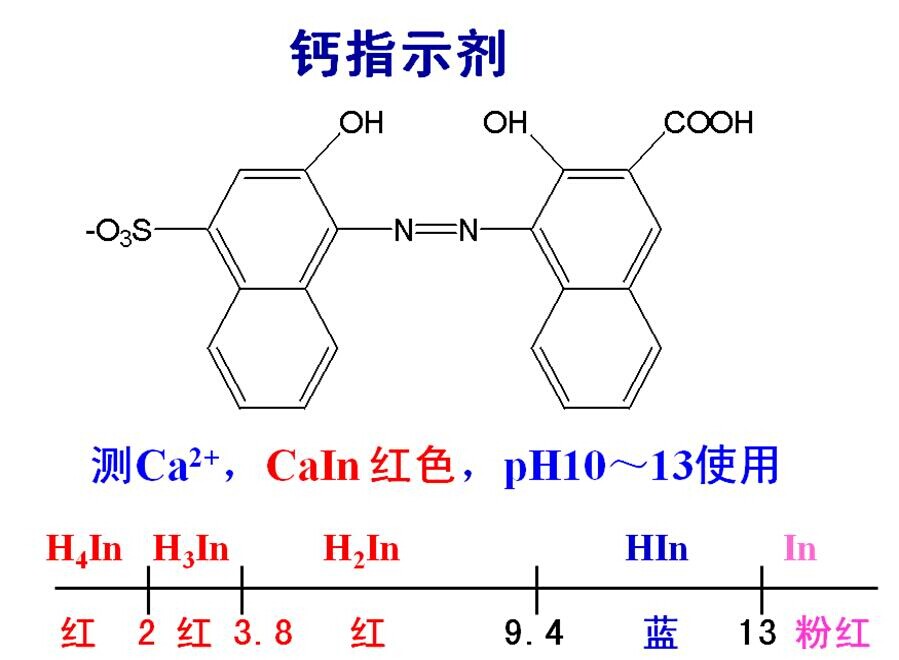
其變色范圍:
通過查閱鈣試劑的變化范圍可知鈣指示劑與金屬離子配合物顯紅色,所以鈣指示劑只能在pH=12~13時使用才顯藍色。在實際的運用中鈣試劑通常是在pH=13時滴定鈣離子(Ca2+)在滴定終點時的滴定液顏色為純藍色。因為在pH=13的情況下溶液中所含有的鎂離子(Mg2+)會全部生成氫氧化鎂(Mg(OH)2)沉淀降低其干擾,所以在加入氫氧化鉀溶液后,調節滴定液的pH=13時為最佳!然而在實際測定過程中由于多加一滴或者少加一滴導致滴定液的pH值偏離最適合的范圍從而會產生一度程度的檢驗誤差,對最終結果的判定造成影響。
二、滴定溶液顏色變化的判斷對檢驗結果的影響
整個檢驗過程中最重要最關鍵的操作就是滴加EDTA的過程,也是最容易引起檢驗結果誤差的地方。滴加EDTA體積的多少,對滴定過程中顏色判斷是否準確,都會直接影響到最后的檢驗結果的判定。
按GB1892-2007中的第6.4.3分析步驟中提供的顏色變化應該是由:
橙紅色—— 酒紅色——純藍色這一顏色的變化過程中的橙紅色到酒紅色的變化過程不太明顯,主要是指其中的橙紅色顯色不明顯。
原因是由于第6.4.3分析步驟中“加入1滴甲基紅指示液”引起,在加入甲基紅指示液后滴定液呈淡粉紅色,在滴加氫氧化鉀溶液的過程中由淡粉紅色逐漸消失,在pH≈12時顯很亮的橙色,同時在滴定液中可以觀察到有絮狀的沉淀物出現。在加入三乙醇胺后滴定溶液的pH≈13,則在合適的滴定范圍內。在此滴定液中加入鈣試劑后滴定液的顏色則變成酒紅色,這一過程的顏色變化比較明顯很容易判斷。
其顏色變化如下圖:



加入甲基紅指示液后的顏色 加入KOH溶液和三乙醇胺的顏色 加入鈣試劑后的顏色
對滴定液由酒紅色變化為純藍色的滴定過程的判斷是否準確,會對檢驗結果造成直接的影響,所以要對其變色的機理十分了解。EDTA測定鈣離子(Ca2+)的變色原理是由于pH=13~14時,在三乙醇胺掩蔽消除干擾離子影響的情況下,首先是鈣指示劑與溶液中的鈣離子(Ca2+)絡合成酒紅色,隨著滴入EDTA
由于形成更穩定的EDTA-Ca絡合物,鈣指示劑變成藍色的游離狀態,終點是溶液呈純藍色。

標準純藍色
滴定終點時溶液的顏色如下圖


正面照片 側面照片
在整個滴加EDTA標準滴定液的過程中滴定液的顏色變化過程是由酒紅色逐漸變成淺紫紅色,繼續滴加EDTA標準滴定液時整個滴定液會在某一瞬間變成無色,這一過程會很迅速,再繼續滴加EDTA標準滴定液時滴定液則由淺藍色變成純藍色。當滴定液滴定終點顏色為純藍色時,再多加一滴EDTA標準滴定液則整個滴定液的顏色會變成亮藍色。對這一過程的判斷是否準確,直接影響到EDTA標準滴定液體積的讀取。如果由紫紅色直接過渡到純藍色,而沒有逐漸變化的過程,那最后的檢驗結果會比實際值偏小,如果直接過渡到亮藍色則剛好相反。
下面對整個滴過程中,滴定液中鈣離子(Ca2+)濃度的變化做一個初步的討論,在絡合滴定中滴定液金屬離子濃度的變化可以用配位滴定曲線來表示。
配位滴定曲線的定義為:用金屬離子濃度[M]的負對數表示其濃度大小,pM=-lg[M],根據pM值與對應加入的滴定劑體積值所作出的曲線。
今以EDTA 0.05mol/l滴定 20ml 0.05mol/l 的Ca2+為例來討論其配位滴定曲線,通過相關的計算可以得出下表:
EDTA用量 | 剩余Ca2+ 體積/ml | 過量EDTA體積/ml | [Ca2+] /(mol/l) | p Ca2+ | |
加入毫升數/ml | 滴定/% | ||||
0 | 0 | 20.00 | 0.05 | 1.30 | |
10.00 | 50 | 10.00 | 1.67*10-3 | 2.78 | |
18.00 | 90 | 2.00 | 2.6*10-4 | 3.59 | |
19.80 | 99 | 0.20 | 2.5*10-5 | 4.60 | |
19.98 | 99.9 | 0.02 | 2.5*10-6 | 5.60 | |
20.00 | 100.0 | 0.00 | 5.1*10-7 | 6.30 | |
20.02 | 100.1 | 0.02 | 1.1*10-7 | 8.00 | |
20.20 | 101 | 0.20 | 1.1*10-8 | 9.00 | |
根據上表中的相關數據可以繪制其配位滴定曲線如下圖:
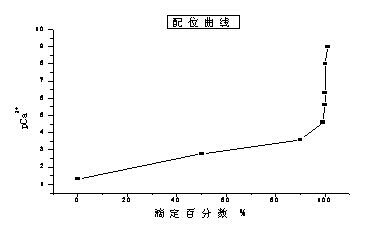
注:黃色部分為滴定突躍過程,也就是顏色變化的關鍵過程。
在表中可以很直觀的看出在滴定終點時要應注意:當滴定液如下圖顏色的時候,操作者誤認為已經到滴定終點了,實際上這其實是反應完成99%的顏色,因此會引起最后檢驗結果的偏小。反之,當操作者多滴2滴時,溶液將會變成亮藍色,這又會造成檢驗結果的偏大。
如下圖


滴定完成99%時的照片 亮藍色照片

標準亮藍色
另外,加入鈣指示劑量的多少也會對檢驗結果產生影響,通過查閱一些資料和實際檢驗操作的驗證加入鈣指示劑的量在0.1g~0.2g時最佳。加入的鈣指示劑量過少,最終的檢驗結果會比實際值偏小,過多也則會偏大。
當加入的鈣試劑的量過少時,滴定液的酒紅色會比較淺,與鈣試劑絡合的鈣離子(Ca2+)較少,在加入EDTA滴定液的過程中,游離出來的鈣試劑的量也會比實際值偏小,導致滴定終點時滴定液的顏色比較淺,使加入的EDTA標準滴定液的體積比實際值要小。當加入的鈣試劑的量過多時,由于鈣試劑變色的原理是在滴定終點時EDTA與鈣離子(Ca2+)形成更穩定的EDTA-Ca絡合物,鈣指示劑變成藍色的游離狀態,但是由于加入的鈣試劑的量較多,滴定液里存在未參加絡合的鈣試劑,使整個滴定液呈褐色與藍色混合色,混合顏色較深不容易判定是否為終點,會導致需要加入更多的EDTA標準滴定液使滴定液的顏色變為純藍色,從而使檢驗結果偏大。
同時也要注意避免因為指示劑的氧化變質引起的檢驗誤差,這一點可以通過分析鈣試劑的分子結構式得出,在這里就不加以敘述。
另外需要提醒的是:加入鈣指示劑后,不能放置過久,否則滴定終點發灰不明顯,會對檢驗結果造成不利影響。
三、樣品的干燥程度對檢驗結果的影響
在GB1892-2007中的第6.4.3分析步驟中所取的樣品是指“稱取約0.1g在250干燥至恒定的樣品”這就是說明如果樣品的干燥程度不足,會對檢驗結果產生影響。硫酸鈣在128℃時失去1.5個分子結晶水,在163時失去所含有的全部結晶水。如果干燥的程度不足在樣品里可能就有半水的硫酸鈣,在滴定的過程中滴加的EDTA標準滴定液的體積會比完全失水的硫酸鈣要少,最后的檢驗結果會偏小。通過實驗可以得出大概在250干燥3~4小時就可以滿足實驗要求,如果測定時空氣濕度較大則需要相應的延長干燥時間。
四、檢驗試劑濃度誤差對檢驗結果的影響
在滴定過程中由于EDTA濃度的對最后的檢驗結果有直接的影響,所以其濃度是否準確就顯的很重要。當標定的濃度相差0.01%時,但是最后的檢驗結果可能就相差了1%!這一點可以通過計算來得出。所以在相同的測定條件下如果EDTA標準滴定液標定的結果存在誤差,那最終的檢驗結果就會產生檢驗誤差,從而對產品的品質判斷產生影響。
五、其它原因導致的誤差對檢驗結果的影響
這主要是指以下幾個方面導致的檢驗誤差:
①儀器誤差 滴定管的刻度不準確又未經校正,天平在使用是沒有完全預熱就稱量或者在稱量之前沒有校正。那么在滴定的過程中也會對檢驗結果產生影響。
②環境誤差 由于測定環境是影響所帶來的檢驗誤差。在不同的溫度下,玻璃的膨脹系數不同,不同的濕度樣品吸濕的程度不同,灰塵也會影響檢驗結果。
③其它原因導致的誤差
綜上所述:在測定硫酸鈣有效含量的操作過程中,要對整個滴定過程滴定液的顏色的變化要有很直觀的了解。對會引起檢驗結果發生偏差的條件因素,在檢驗的過程中要盡量的消除或者避免,同時也要提升檢驗員自我的檢驗水平和使用精密度更高的儀器來確保檢驗結果的準確性。
參考資料:
[1]劉世純編 《實用分析化驗工讀本》 第五章 136~151;
[2]李云章編 《化學試劑第三版 硫酸鈣 018650》》245;
[3] 《ISO6058 水質鈣含量的測定——EDTA滴定法》;
[4]化學實驗室常用分析測試操作技術標準應用手冊編寫組編 《化學實驗室常用分析測試操作技術標準應用手冊》 第六章442~448 ;
[5]張水華編 《食品分析》 第六章 72~73 ;
[6]國家質量監督管理局 《GB 1892-2007 食品添加劑 硫酸鈣》;
[7]曾云鶚 張華山 陳震華編 《現代化學試劑手冊 第四分冊 無機離子顯色劑》270~271 ;
[8]周同惠編 《分析化學手冊(第二版)第一分冊 基礎知識與安全知識》350~356 ;
[9]夏玉宇編 《化驗員實用手冊 第三部》 第十章 525~546;
[10]夏玉宇編 《化驗員實用手冊 第二部》 第五章 230~234